中國醫(yī)藥化工網(wǎng)訊

中國仿制藥質(zhì)量參差不齊,與歐美甚至印度差距巨大,國家食藥監(jiān)總局下決心重新“清洗”,可以預(yù)見,到截止日期2018年底,中國將有一大批耳熟能詳?shù)乃幤废?,同時(shí),制藥企業(yè)也將進(jìn)入淘汰重組。
一份“意見”的落地,引發(fā)了制藥行業(yè)少有的大震動(dòng)。
近日,國家食藥監(jiān)總局(CFDA)下發(fā)《國務(wù)院辦公廳關(guān)于開展仿制藥質(zhì)量和療效一致性評(píng)價(jià)的意見》,凡是2007年10月1日前批準(zhǔn)上市并列入“國家基本藥物目錄”的化藥仿制藥須在2018年底前完成一致性評(píng)價(jià)。
一致性,即仿制藥必須與原研藥在管理、中間過程、質(zhì)量等方面保持一致,否則,患者用藥安全難以保證。
由于缺乏創(chuàng)新,中國化藥中95%以上均為仿制藥,質(zhì)量參差不齊,極少出口至海外。而同為仿制藥大國的印度,其產(chǎn)品80%左右出口歐美,兩者差距可見一斑。
《意見》圈定289個(gè)仿制藥品種,涉及2萬多種藥物,幾乎所有制藥廠商均有產(chǎn)品需要做一致性評(píng)價(jià),巨額支出不可避免。業(yè)內(nèi)普遍估算,一次評(píng)價(jià)大約400萬-500萬元。
此外,以2018年底作為最后期限,時(shí)間十分緊張,據(jù)業(yè)內(nèi)人士向21世紀(jì)經(jīng)濟(jì)報(bào)道記者透露,從申報(bào)參比試劑,到處方工藝的二次開發(fā),到BE備案和BE試驗(yàn),再到最后的評(píng)審審批,至少需要22個(gè)月左右。
“這僅是完成受理的時(shí)間,而不是最后評(píng)審?fù)ㄟ^的時(shí)間,而且是在一切都正常通過,不包括評(píng)價(jià)失敗、重新評(píng)審的時(shí)間。”上述人士說。
因此,《意見》下發(fā)的合理預(yù)測(cè)是,到2018年底,中國市場(chǎng)上將消失大量曾經(jīng)耳熟能詳?shù)乃幬?,一些?shí)力較差的藥企也將被淘汰出局。
藥企陷入成本、時(shí)間焦慮
由于高昂的成本和緊迫的時(shí)間,藥企普遍陷入焦慮。
全國人大代表、 亞寶藥業(yè) 董事長任武賢此前接受21世紀(jì)經(jīng)濟(jì)報(bào)道記者采訪時(shí)表示,目前一致性評(píng)價(jià)一個(gè)品種300萬元是友情價(jià),500萬元是市場(chǎng)價(jià)。
有業(yè)內(nèi)一機(jī)構(gòu)細(xì)致解析了一致性評(píng)價(jià)的行情:原輔料采購50萬,結(jié)構(gòu)確證和驗(yàn)證10萬元(晶型、雜質(zhì)、粒度),工藝驗(yàn)證、動(dòng)態(tài)生產(chǎn)、小中試生產(chǎn)10萬元,注冊(cè)及檢驗(yàn)費(fèi)25萬元,人力成本100萬元,BE試驗(yàn)250萬元。
如果一家藥企有100種藥品做一致性評(píng)價(jià),則需要為此支付5億元。
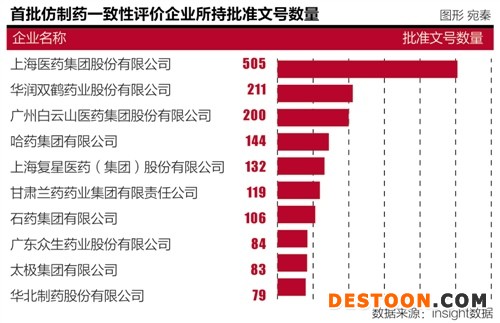
據(jù)insight數(shù)據(jù),此次入選首批一致性評(píng)價(jià)品種批文最多的企業(yè)分別是 上海醫(yī)藥 集團(tuán)、 華潤雙鶴 藥業(yè)、廣藥 白云山 醫(yī)藥集團(tuán)、哈藥集團(tuán)有限公司、上海 復(fù)星醫(yī)藥 ,批準(zhǔn)文號(hào)數(shù)量分別是505、211、200、144、132個(gè)。若2.67萬個(gè)品種都做一致性評(píng)價(jià)的話,預(yù)計(jì)花費(fèi)1000億元。
更為令藥企頭疼的還不僅僅是錢的問題,由于一致性評(píng)價(jià)試驗(yàn)資源如實(shí)驗(yàn)室、醫(yī)院的稀缺,常常出現(xiàn)找不到實(shí)驗(yàn)室的尷尬。
在一致性評(píng)價(jià)生態(tài)鏈中涉及藥企、藥學(xué)機(jī)構(gòu)、臨床CRO、BE基地、生物樣品檢測(cè)、數(shù)據(jù)統(tǒng)計(jì)等7方,環(huán)環(huán)相扣。其中,BE實(shí)驗(yàn)這一環(huán)節(jié)讓很多企業(yè)“頭疼”。
去年7月22日開始藥物臨床實(shí)驗(yàn)自查核查后,具備BE資格的醫(yī)院承接臨床實(shí)驗(yàn)積極性不高,由于醫(yī)院承接臨床實(shí)驗(yàn)掙的是床位管理費(fèi),但很多醫(yī)院床位都供不應(yīng)求,醫(yī)院并不愿意增加臨床實(shí)驗(yàn)床位。
據(jù)統(tǒng)計(jì),目前具有BE資格認(rèn)定有53家機(jī)構(gòu),平均大概20個(gè)床位,一年能夠承接的BE量在30個(gè)左右,以此計(jì)算,每年能夠通過核查不會(huì)超過2000個(gè)品種,三年能夠完成的品種只有6000個(gè)。而2012版《國家基本藥物目錄》中涉及一致性評(píng)價(jià)品種約300個(gè),2.67萬多個(gè)批準(zhǔn)文號(hào)。
“臨床實(shí)驗(yàn)機(jī)構(gòu)短缺,BE機(jī)構(gòu)也開始挑項(xiàng)目,甚至?xí)芙^一些項(xiàng)目。”一位上市藥企董事長向21世紀(jì)經(jīng)濟(jì)報(bào)道記者表示。另據(jù)某行業(yè)媒體報(bào)道,由于資源緊張,目前已經(jīng)有藥企開始談壟斷醫(yī)院BE資源,雙方約定,該醫(yī)院只做這家公司一家的BE實(shí)驗(yàn),從文號(hào)上就擠壓競(jìng)爭對(duì)手。
安徽萬邦醫(yī)藥科技有限公司總經(jīng)理陶春蕾曾在某行業(yè)會(huì)議上用“焦慮”一詞來形容整個(gè)一致性評(píng)價(jià)生態(tài)鏈的現(xiàn)狀。
在上述數(shù)據(jù)核查風(fēng)暴中,1622個(gè)品種80%以上撤回,企業(yè)申辦方、CRO、臨床機(jī)構(gòu)、藥監(jiān)部門都曾短暫陷入信任危機(jī),國內(nèi)BE試驗(yàn)也被“全盤否定”。其中不乏大的上市藥企,甚至以研發(fā)著稱的 恒瑞醫(yī)藥 亦有投入上億的重磅品種主動(dòng)撤回。
即使有錢、有BE實(shí)驗(yàn)室,也并不意味著能在規(guī)定時(shí)間內(nèi)完成一致性評(píng)價(jià)。至2018年底,共有30月的時(shí)間,十分緊張。
一致性評(píng)價(jià)分為研究和申報(bào)兩個(gè)階段,不考慮各因素干擾的情況下,預(yù)計(jì)研究階段用時(shí)16-20個(gè)月,申報(bào)階段用時(shí)6-8個(gè)月,企業(yè)要趕在2018年年底完成一致性評(píng)價(jià)時(shí)間非常緊迫。
“時(shí)間真的挺緊張,我們決定從三個(gè)藥品里選出一個(gè)來做一致性評(píng)價(jià)。”一位藥企負(fù)責(zé)人近日在接受21世紀(jì)經(jīng)濟(jì)報(bào)道記者采訪時(shí)表示。據(jù)悉,出于時(shí)間和成本考量,企業(yè)的應(yīng)對(duì)之策大多為“取舍”。
北京鼎臣醫(yī)藥管理咨詢負(fù)責(zé)人史立臣表示,藥企必須做出一個(gè)最優(yōu)的選擇,因?yàn)榈浆F(xiàn)在給藥企的時(shí)間確實(shí)不多了,而且還存在臨床試驗(yàn)塞車等各種問題。
“不過,此舉可謂是仿制藥行業(yè)的供給側(cè)改革,未來醫(yī)藥行業(yè)的并購將加速。未來50%的藥品批文將會(huì)被淘汰。但這將有助于搶到賽道的企業(yè)迅速擴(kuò)大市場(chǎng)。”
受此影響,業(yè)內(nèi)人士測(cè)算,在289個(gè)評(píng)價(jià)品種的近2萬個(gè)文號(hào)中,考慮有太多劑型與原研不一致,能夠迅速開展評(píng)價(jià)的大約為1萬個(gè)文號(hào)。
不過,《意見》同時(shí)規(guī)定,自第一家企業(yè)品種通過一致性評(píng)價(jià)后,三年后不再受理其他藥品生產(chǎn)企業(yè)相同品種的一致性評(píng)價(jià)申請(qǐng)。這意味著,通過評(píng)價(jià)的藥企在某種藥物上具有三年壟斷期,對(duì)實(shí)力較強(qiáng)的大企業(yè)是一個(gè)利好信息。
淘汰低端產(chǎn)能
在業(yè)界看來,此次CFDA對(duì)藥企動(dòng)“真格”,實(shí)際也是“無奈且必須”的舉措。
中國仿制藥質(zhì)量參差不齊,影響患者用藥安全。國家食藥總局藥品認(rèn)證管理中心處長李正奇曾撰文稱,國產(chǎn)仿制藥總體質(zhì)量比原研藥相差遠(yuǎn),有的甚至是安全的無效藥。
國信證券 估算,仿制藥規(guī)模近5000億元,在處方量中占比達(dá)95%。然而大量國產(chǎn)仿制藥粗制劣造、安全無效,行業(yè)毛利率不到10%,遠(yuǎn)低于國際平均50%的水平。
據(jù)了解,CFDA曾于2008年組織過一次摸底抽查,選擇部分國產(chǎn)仿制藥與原研藥進(jìn)行體外溶出試驗(yàn)比較,發(fā)現(xiàn)國產(chǎn)仿制藥與原研藥體外溶出行為差異懸殊,無一能達(dá)到合格標(biāo)準(zhǔn)。
同為仿制藥大國的印度,其藥品制備體系及標(biāo)準(zhǔn)均按歐美國家設(shè)置,80%左右的仿制藥出口至發(fā)達(dá)國家。但中國的仿制藥極少能夠獲得國外市場(chǎng)的認(rèn)可。
除此之外,中國的仿制藥事實(shí)上大部分占用文號(hào),但并不生產(chǎn)。
國信證券援引相關(guān)數(shù)據(jù)指出,目前藥監(jiān)局共批準(zhǔn)了18.9萬個(gè)仿制藥品種,但實(shí)際生產(chǎn)銷售的批準(zhǔn)文號(hào)只有4萬-5萬個(gè),2/3的藥品文號(hào)是沒有實(shí)際生產(chǎn)的“僵尸文號(hào)”。
實(shí)際上,一致性評(píng)價(jià)并非僅是“中國特色”。
海安必生制藥CEO雷繼峰向21世紀(jì)經(jīng)濟(jì)報(bào)道記者指出,在歐洲、美國、日本,藥企也都曾經(jīng)歷過仿制藥一致性評(píng)價(jià)“陣痛”,被視為“大清洗”的利器。
如20世紀(jì)70年代,美國歷時(shí)10年,淘汰了約6000種不合格藥品;1975年前后,英國對(duì)36000種藥品進(jìn)行評(píng)價(jià)檢查;1997年,日本啟動(dòng)“藥品品質(zhì)再評(píng)價(jià)工程”,至今完成了約730個(gè)品種。經(jīng)過“再評(píng)價(jià)工程”,三個(gè)國家都實(shí)現(xiàn)了仿制藥行業(yè)的升級(jí),藥品質(zhì)量、行業(yè)生態(tài)、工業(yè)價(jià)值都得到顯著提高。
業(yè)內(nèi)普遍預(yù)測(cè),中國也將借此契機(jī),淘汰醫(yī)藥行業(yè)低端產(chǎn)能,加速行業(yè)兼并重組。
“這在一定程度上也將加劇行業(yè)的兼并重組。一些資金實(shí)力較弱的小企業(yè)如若有好的品種,可以尋求大企業(yè)的支持。”史立臣表示。
而在中德證券有限公司黃屹博士看來,“現(xiàn)在我國醫(yī)藥市場(chǎng)在全球是坐三望二的位次,但企業(yè)實(shí)力與跨國巨頭相去甚遠(yuǎn)。美國前十強(qiáng)制藥企業(yè)約占市場(chǎng)份額的52.23%,我國醫(yī)藥前十強(qiáng)所占份額只有18%。CFDA已批準(zhǔn)99867個(gè)化學(xué)藥品文號(hào),監(jiān)測(cè)到有銷售的批文只有40816個(gè),占比40.87%,過半品種高度重復(fù),活躍度不高。”
有業(yè)內(nèi)人士以高血壓重點(diǎn)品種舉例稱,美國仿制藥整體占比為75%,我國原研藥整體占比是62%。國內(nèi)市場(chǎng),10家原研藥公司壟斷了94%原研藥市場(chǎng),這些公司包括諾華、阿斯利康、輝瑞等等;共有350家企業(yè)在銷售高血壓仿制藥品,前15名企業(yè)僅覆蓋了55%的市場(chǎng)份額,這些企業(yè)包括施慧達(dá)、正大天晴、揚(yáng)子江、石藥集團(tuán)。
中國人民大學(xué)醫(yī)藥衛(wèi)生行業(yè)發(fā)展研究中心首席專家徐東基分析, 中國醫(yī)藥 行業(yè)從2013年開始就已經(jīng)進(jìn)入供給老化階段,產(chǎn)業(yè)要想發(fā)展,必須面對(duì)社會(huì)資本涌入與結(jié)構(gòu)調(diào)整、產(chǎn)業(yè)形態(tài)調(diào)整、產(chǎn)業(yè)供給側(cè)結(jié)構(gòu)重大調(diào)整。




 110102000668(1)號(hào)
110102000668(1)號(hào)