11月CDE共承辦藥品注冊申請963件;7個(gè)存量品種首次有企業(yè)申報(bào)一致性評價(jià);3個(gè)1類新藥報(bào)產(chǎn),其中2個(gè)為中成藥;仿制申請有27個(gè)品種暫無國產(chǎn)獲批;3個(gè)1類新藥,3個(gè)進(jìn)口原研要獲批;7個(gè)首仿品種獲批,6個(gè)存量品種首家過評。
CDE總體承辦情況
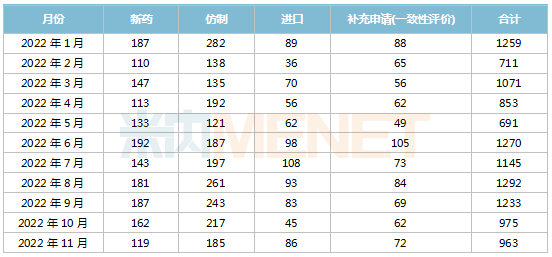
據(jù)米內(nèi)網(wǎng)中國申報(bào)進(jìn)度(MED)數(shù)據(jù)庫統(tǒng)計(jì),2022年11月CDE共承辦藥品注冊申請963件。
2022年1月-11月CDE承辦藥品注冊申請情況(按受理號(hào)計(jì))
一致性評價(jià)補(bǔ)充申請承辦情況
2022年11月,48個(gè)品種的一致性評價(jià)補(bǔ)充申請獲CDE承辦。阿莫西林克拉維酸鉀干混懸劑(14:1)、吡嘧司特鉀片、復(fù)方電解質(zhì)注射液(Ⅱ)、米格列奈鈣片、瑞巴派特片、替米沙坦氫氯噻嗪片、鹽酸甲氧氯普胺注射液等7個(gè)品種為首次申報(bào)。
11月CDE補(bǔ)充申請(一致性評價(jià))品種承辦情況


新藥申請承辦情況
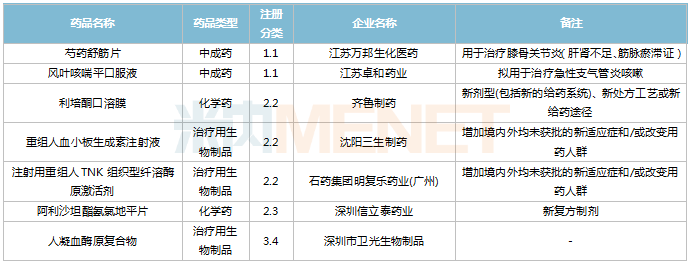
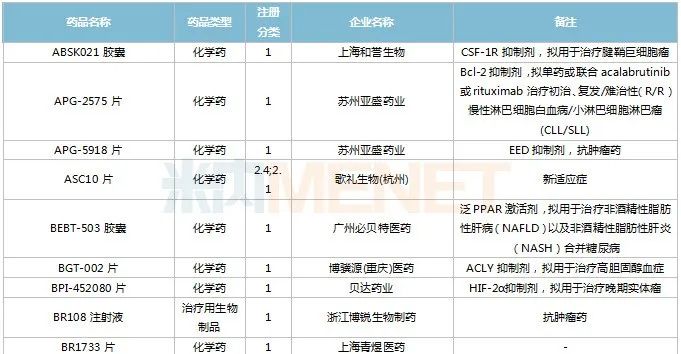
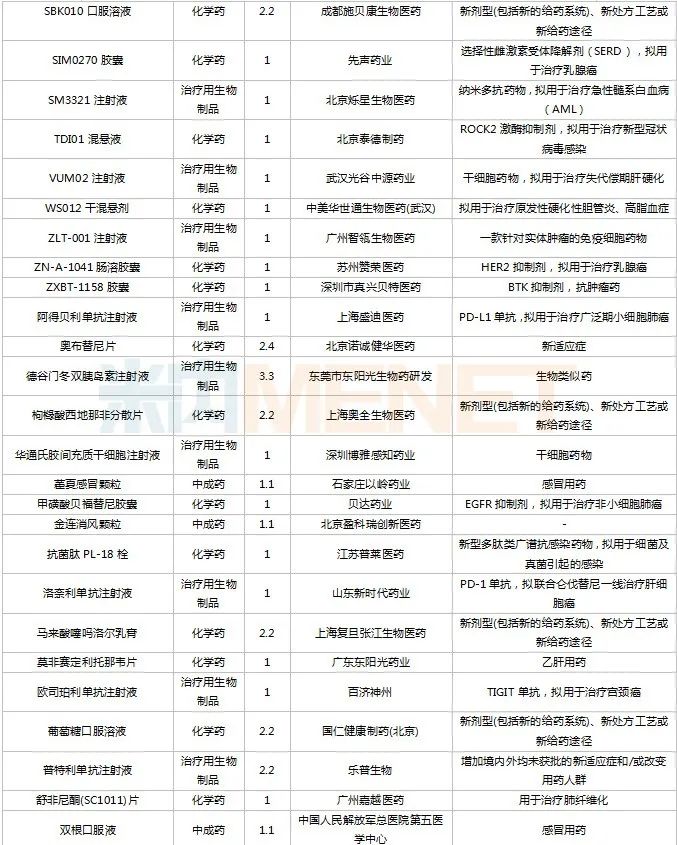
2022年11月,83個(gè)品種的新藥申請獲CDE承辦。1類新藥有63個(gè),其中中成藥有6個(gè),2類改良型新藥有19個(gè),生物類似藥1個(gè)。江蘇萬邦生化醫(yī)藥的1.1類中成藥芍藥舒筋片以及江蘇卓和藥業(yè)的1.1類中成藥風(fēng)葉咳喘平口服液申報(bào)上市。沈陽三生制藥的重組人血小板生成素注射液以及石藥集團(tuán)明復(fù)樂藥業(yè)(廣州)的注射用重組人TNK組織型纖溶酶原激活劑為新適應(yīng)癥上市申請。
11月國內(nèi)新藥上市申請承辦情況
11月國內(nèi)新藥臨床申請承辦情況

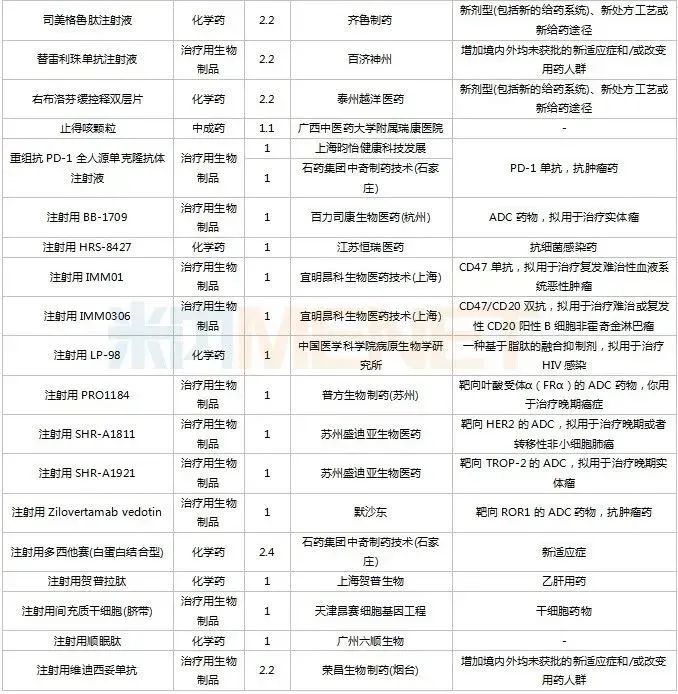
仿制申請承辦情況
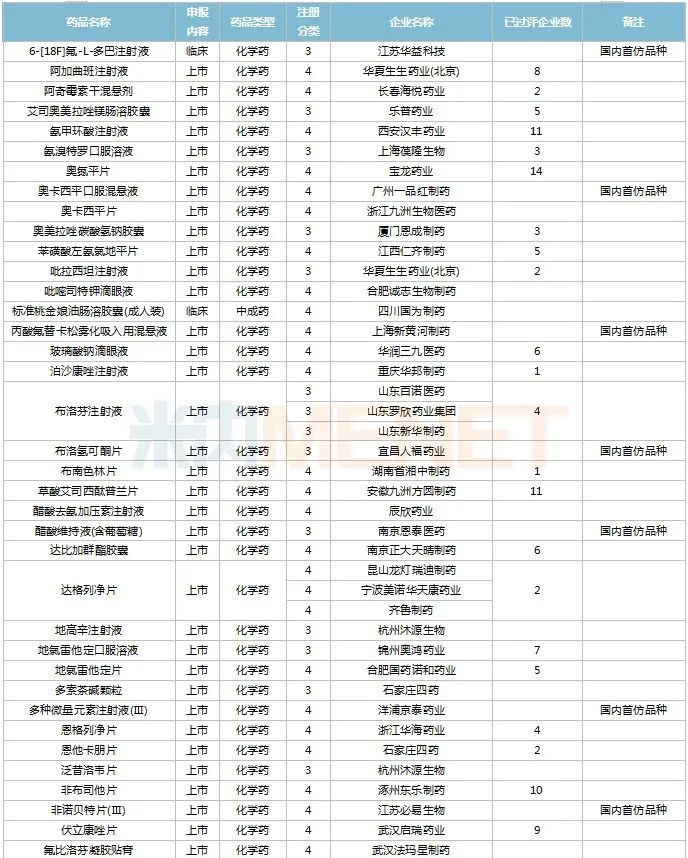
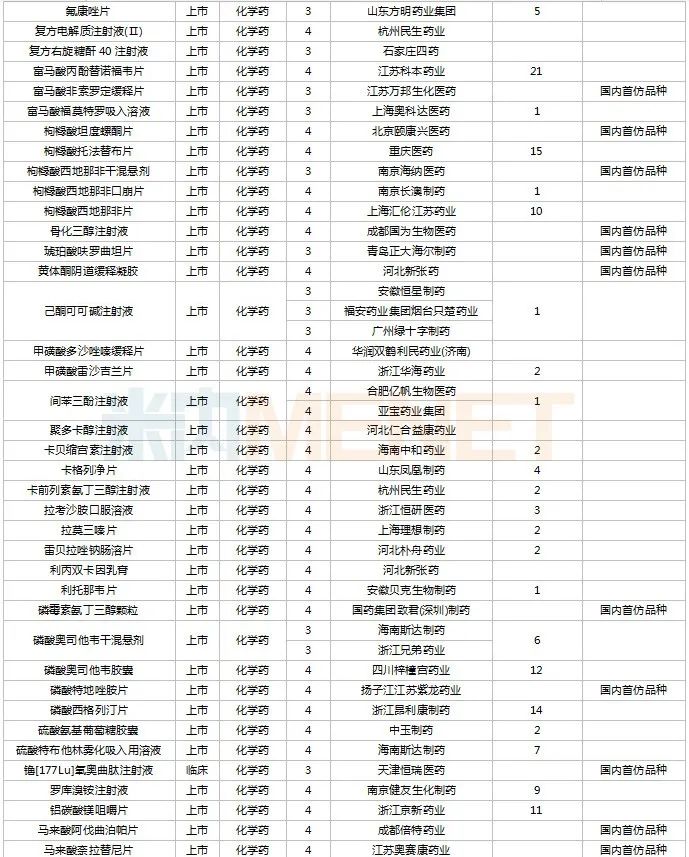
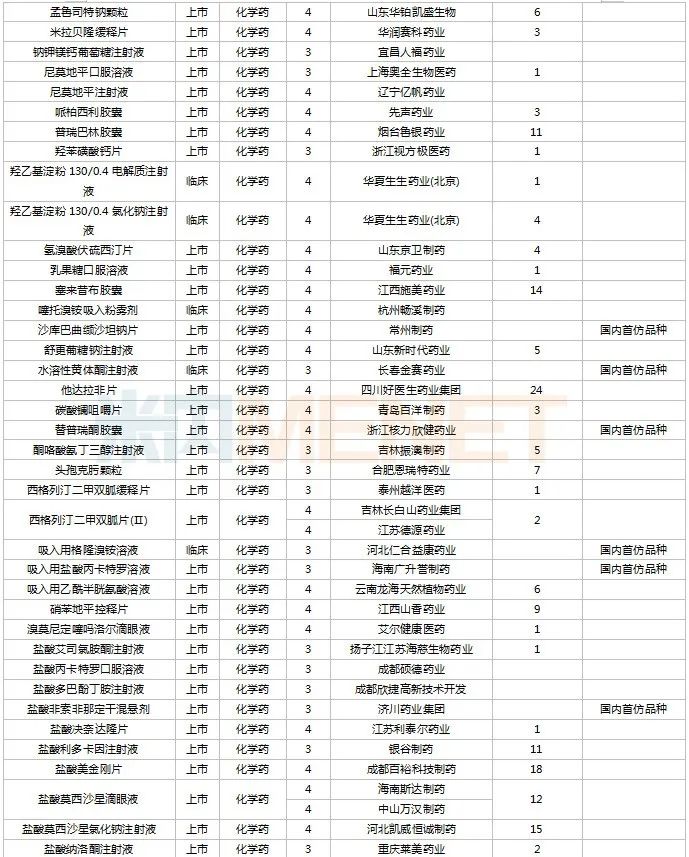
2022年11月,130個(gè)品種的仿制申請獲CDE承辦,其中6-[18F]氟-L-多巴注射液、奧卡西平口服混懸液、丙酸氟替卡松霧化吸入用混懸液、布洛氫可酮片、醋酸維持液(含葡萄糖)、多種微量元素注射液(Ⅲ)、非諾貝特片(Ⅲ)、富馬酸非索羅定緩釋片、枸櫞酸坦度螺酮片、枸櫞酸西地那非干混懸劑、骨化三醇注射液……等27個(gè)品種目前暫無國產(chǎn)仿制藥獲批。
11月國內(nèi)仿制申請承辦情況
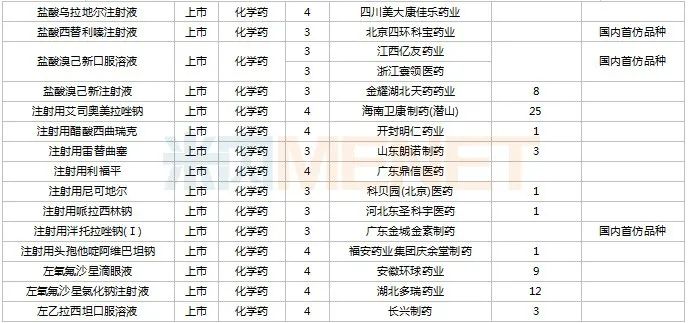
進(jìn)口申請承辦情況
2022年11月,43個(gè)品種的進(jìn)口申請獲CDE承辦。其中1類新藥有21個(gè),2類改良型新藥有5個(gè),5.1類進(jìn)口原研藥有10個(gè),5.2類進(jìn)口仿制藥有5個(gè)。
11月進(jìn)口上市申請承辦情況
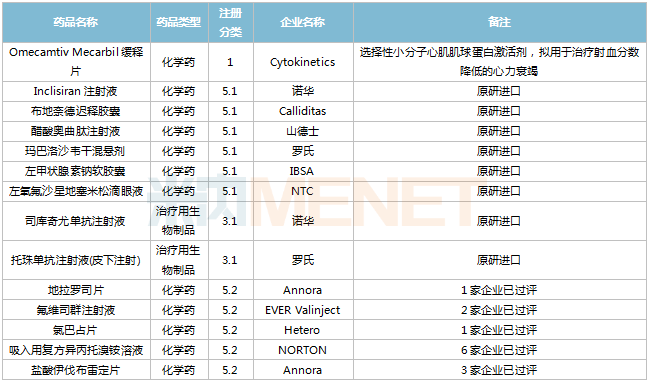
11月進(jìn)口臨床申請承辦情況
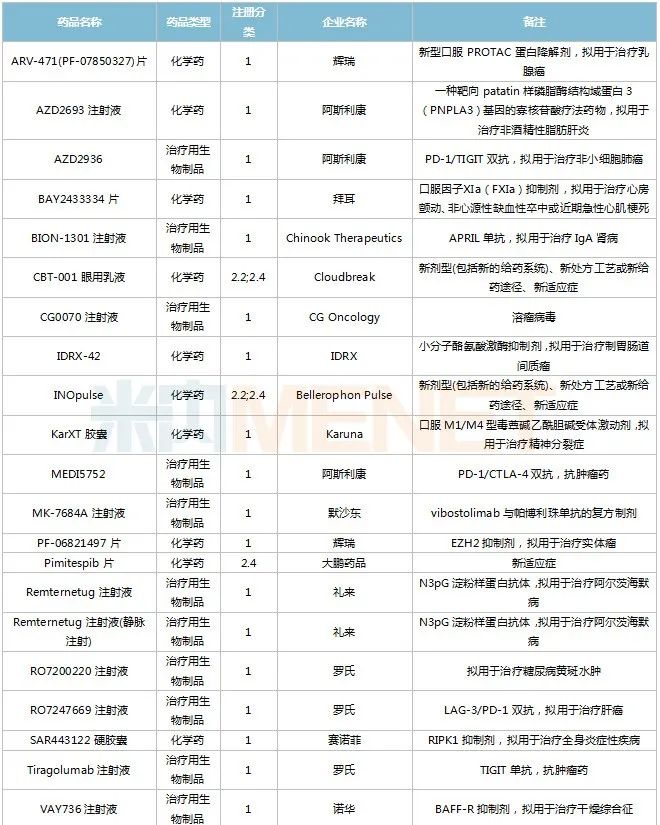
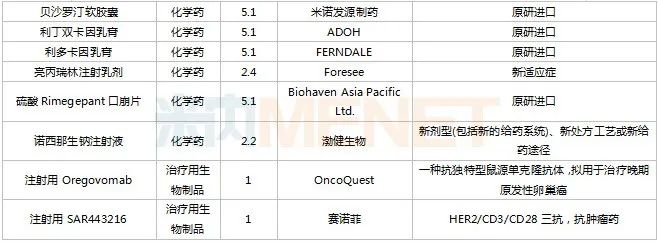
獲批情況
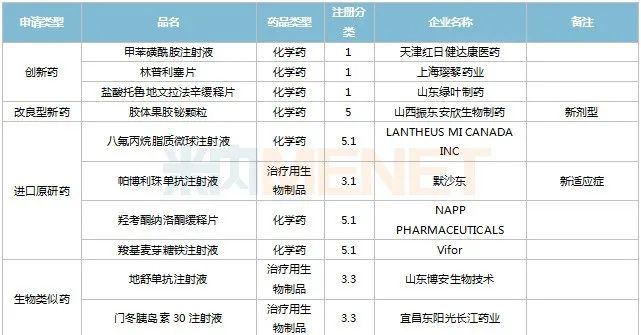
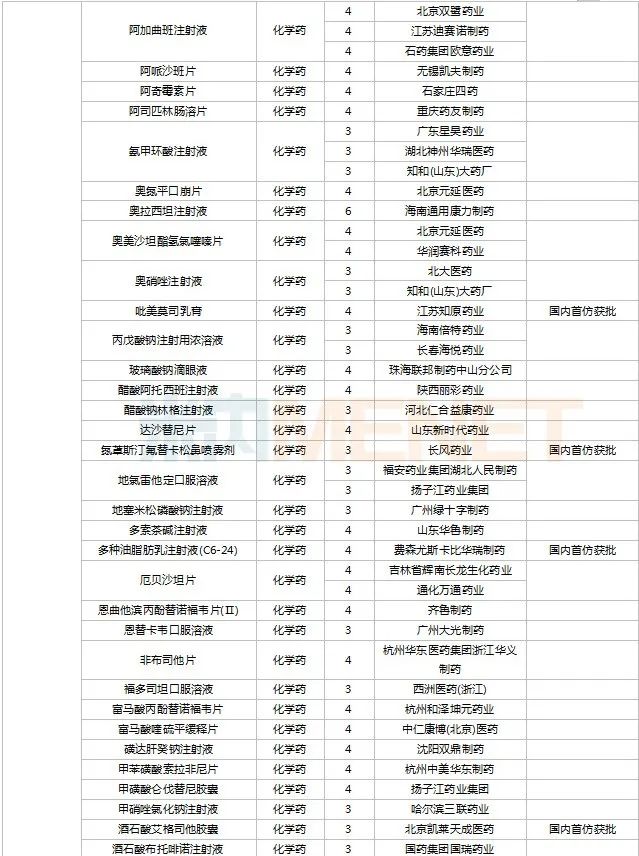
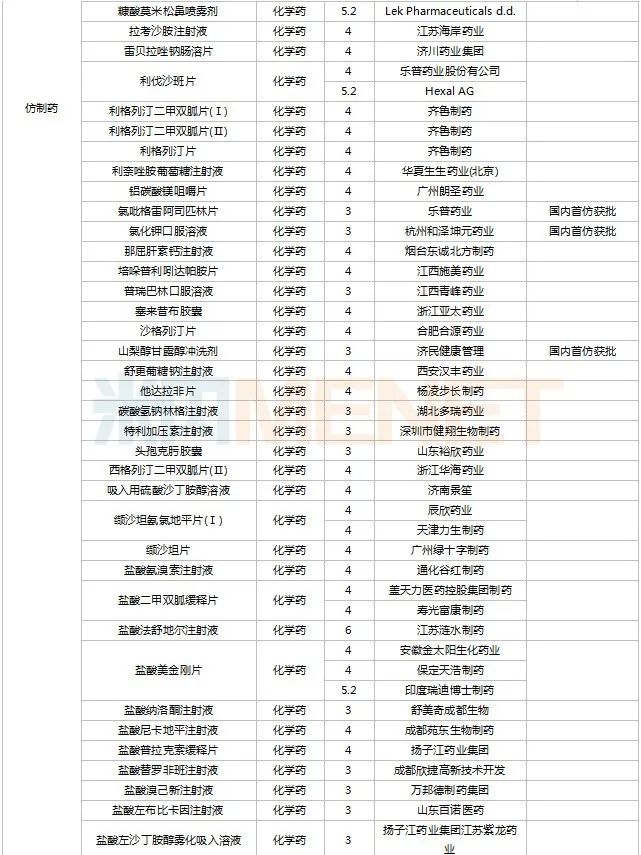
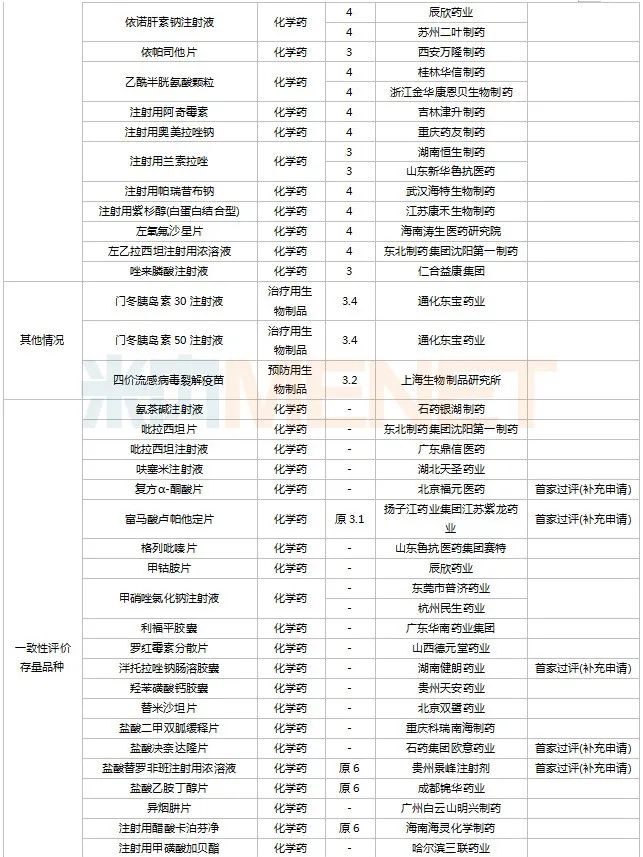
2022年11月,天津紅日健達(dá)康醫(yī)藥、上海瓔黎藥業(yè)、山東綠葉制藥等均有1類新藥獲批上市。山西振東安欣生物制藥的膠體果膠鉍顆粒為新劑型獲批。默沙東的帕博利珠單抗注射液再獲批新適應(yīng)癥。81個(gè)仿制藥獲批上市(含進(jìn)口5.2類),吡美莫司乳膏(江蘇知原藥業(yè))、氮?斯汀氟替卡松鼻噴霧劑(長風(fēng)藥業(yè))、多種油脂肪乳注射液(C6-24)(費(fèi)森尤斯卡比華瑞制藥)、酒石酸艾格司他膠囊(北京凱萊天成醫(yī)藥)、氯吡格雷阿司匹林片(樂普藥業(yè))、氯化鉀口服溶液(杭州和澤坤元藥業(yè))、山梨醇甘露醇沖洗劑(濟(jì)民健康管理)為國內(nèi)首仿品種。26個(gè)存量品種有企業(yè)過評,復(fù)方α-酮酸片、富馬酸盧帕他定片、泮托拉唑鈉腸溶膠囊、鹽酸決奈達(dá)隆片、鹽酸替羅非班注射用濃溶液、注射用哌拉西林鈉等6個(gè)存量品種首次有企業(yè)過評。
11月上市申請品種及一致性評價(jià)品種獲批情況
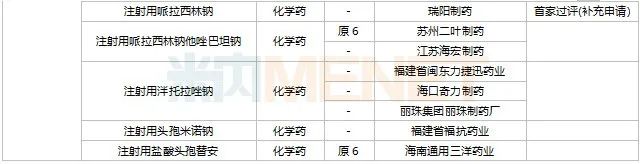
數(shù)據(jù)來源:米內(nèi)網(wǎng)MED2.0藥品審評數(shù)據(jù)庫、CDE、NMPA;相關(guān)統(tǒng)計(jì)字段按藥品名稱統(tǒng)計(jì),時(shí)間截至2022年11月30日;藥物作用靶點(diǎn)以及適應(yīng)癥整理自公開資料。

