2月18日,廣東省藥品監(jiān)督管理局、廣東省衛(wèi)生健康委員會發(fā)布了第二批粵港澳大灣區(qū)內(nèi)地臨床急需進口港澳藥品醫(yī)療器械目錄(以下簡稱“目錄”),包括阿培利司薄膜包衣片、布西珠單抗、卡馬替尼、厄達替尼片、布地奈德緩釋膠囊、注射用羥鈷胺素等6款藥物,以及一款細胞分選/處理系統(tǒng)作為醫(yī)療器械入選,涉及諾華、楊森等多家企業(yè)。
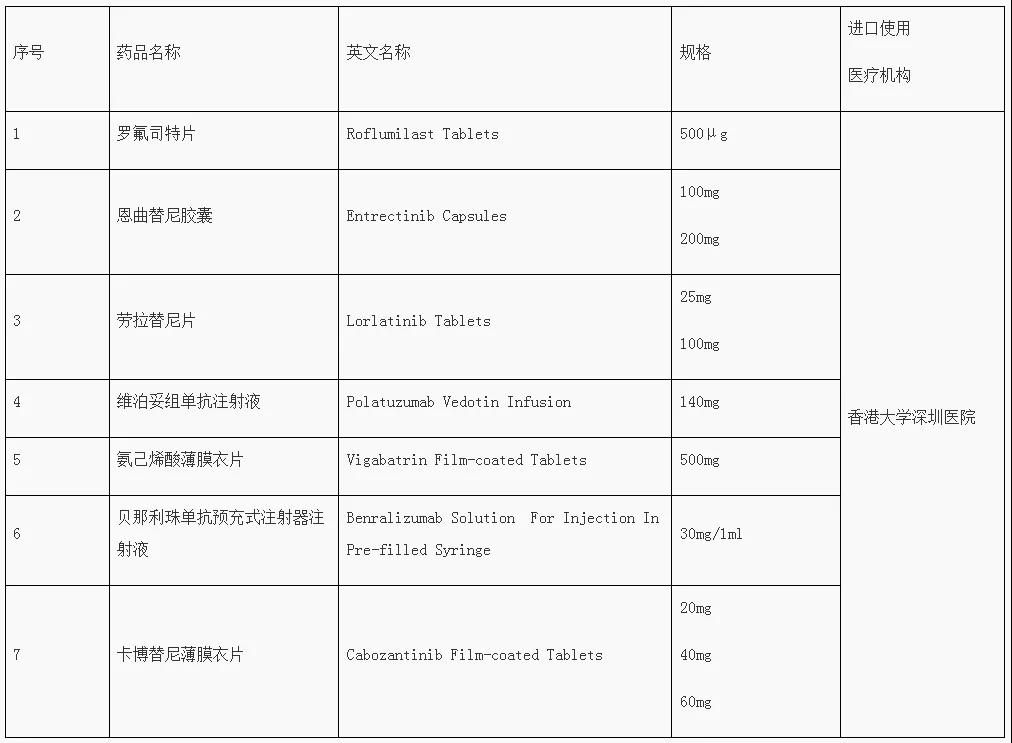
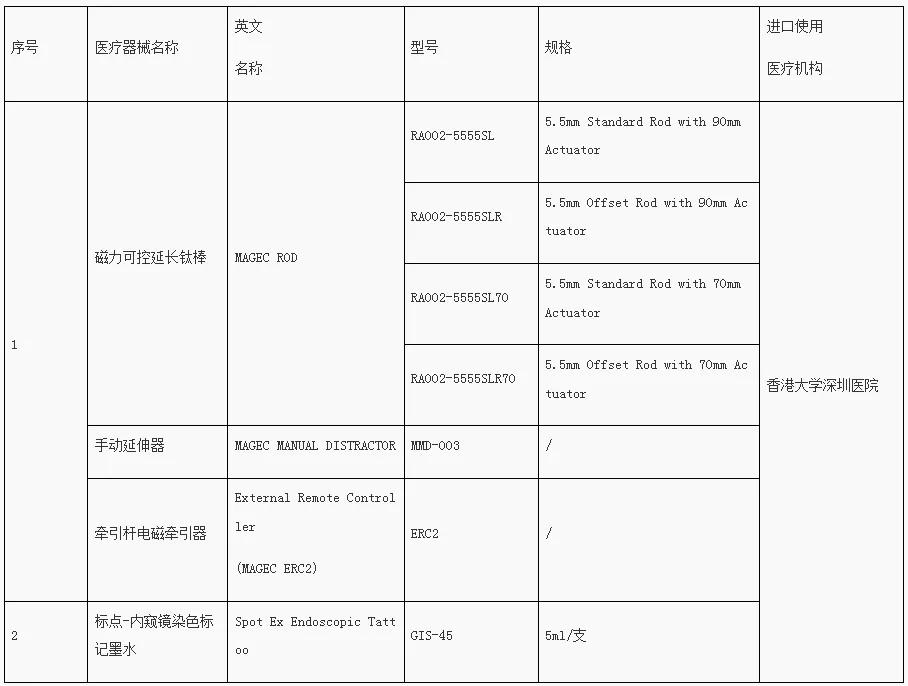
去年8月27日,首批目錄發(fā)布,涉及羅氟司特片、恩曲替尼膠囊等7個藥品;此外,器械產(chǎn)品包括:磁力可控延長鈦棒、手動延伸器、牽引桿電磁牽引器、標點-內(nèi)窺鏡染色標記墨水。
根據(jù)《廣東省粵港澳大灣區(qū)內(nèi)地急需進口港澳藥品醫(yī)療器械管理暫行規(guī)定》(以下簡稱《暫行規(guī)定》),臨床急需進口港澳藥品是指粵港澳大灣區(qū)內(nèi)地醫(yī)療機構(gòu)臨床急需、已在港澳上市的,且不屬于麻醉藥品、精神藥品、興奮劑目錄中的蛋白同化制劑和肽類激素等實施進口準許證管理的藥品;臨床急需進口港澳醫(yī)療器械是指港澳公立醫(yī)院已采購使用、屬于臨床急需、具有臨床應用先進性的醫(yī)療器械(以下簡稱急需藥械)。
《暫行規(guī)定》指出,對進口的急需藥械實行目錄管理,并進行動態(tài)調(diào)整、及時公布。急需藥械應當在申請進口使用的醫(yī)療機構(gòu)用于特定醫(yī)療目的。
多個突破性藥物在列
此次目錄中被納入的“兩替尼一單抗”值得關(guān)注。其中,諾華新藥布西珠單抗(brolucizumab)由珠海?,斄猪槼毖劭漆t(yī)院申請,其微信公眾號顯示,2月9日,依托“港澳藥械通”政策,布西珠單抗獲批在該院使用。
布西珠單抗用于治療年齡相關(guān)性黃斑變性(AMD),據(jù)悉,與內(nèi)地現(xiàn)有的治療手段相比,該藥起效更快、藥效更持久、可減少患者用藥頻率,減少治療風險和創(chuàng)傷,同時對難治病例更有效。布西珠單抗也是目前全球唯一獲批的可在負荷期后每三個月注射一次的抗血管內(nèi)皮生長因子藥物,在針對濕性老年性黃斑變性(wAMD)和糖尿病黃斑水腫(DME)治療中有獨特的表現(xiàn),能最大限度減少視功能的喪失或延緩進展。
厄達替尼是一種每日一次的口服泛成纖維細胞生長因子受體,可阻斷成纖維細胞生長因子受體的活性。該藥于2019年4月獲FDA批準,用于攜帶特定成纖維細胞生長因子受體(FGFR)基因改變的局部晚期或轉(zhuǎn)移性尿路上皮癌(mUC)成人患者,其也是FDA批準的第一種FGFR激酶抑制劑。
卡馬替尼則是美國FDA批準的首個特異性靶向MET外顯子14跳躍突變(METex14)的轉(zhuǎn)移性非小細胞肺癌(NSCLC)的治療藥物。該藥已被批準在海南博鰲樂城國際醫(yī)療旅游先行區(qū)特定醫(yī)療機構(gòu)應用于非小細胞肺癌治療臨床急需。研究數(shù)據(jù)顯示,卡馬替尼在初治和經(jīng)治患者的ORR分別達到67.9%和40.6%,中位OS分別為20.8個月和13.6個月。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2020年卡馬替尼全球銷售額達3500萬美元。
“港澳藥械通”政策的實施,讓粵港澳大灣區(qū)乃至全國的病人,能夠率先使用到在境外已上市的優(yōu)質(zhì)藥械。隨著“港澳藥械通”相關(guān)藥械申報工作的推進,或?qū)⑽镜蒯t(yī)療機構(gòu)與跨國藥企、醫(yī)療科技公司的合作,加快粵港澳三地醫(yī)藥標準的對接,實現(xiàn)粵港澳大灣區(qū)醫(yī)療產(chǎn)業(yè)共同發(fā)展。
加速創(chuàng)新藥械產(chǎn)品可及
2020年9月29日,國家市場監(jiān)督管理總局、國家藥品監(jiān)督管理局等八部委聯(lián)合印發(fā)《粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新發(fā)展工作方案》(下稱《工作方案》),明確授權(quán)“在粵港澳大灣區(qū)內(nèi)地9市開業(yè)的指定醫(yī)療機構(gòu)使用臨床急需、已在港澳上市的藥品,由國家藥監(jiān)局批準改為由國務院授權(quán)廣東省人民政府批準”“區(qū)域內(nèi)開業(yè)的指定醫(yī)療機構(gòu)使用臨床急需、港澳公立醫(yī)院已采購使用、具有臨床應用先進性的醫(yī)療器械,由廣東省政府批準。”
去年1月起,“港澳藥械通”開始試點,7月試點結(jié)束后,在全面總結(jié)試點工作經(jīng)驗的基礎(chǔ)上,廣東省藥監(jiān)局牽頭組織制定印發(fā)了《暫行規(guī)定》等政策配套制度文件,明確了指定醫(yī)療機構(gòu)必須具備的條件、進口藥械的范圍、審批模式、各方責任、風險控制等具體內(nèi)容及要求。
“港澳藥械通”落地以來,國際創(chuàng)新藥械產(chǎn)品的可及進一步提速。據(jù)報道,港大深圳醫(yī)院自獲批成為“港澳藥械通”政策指定試點醫(yī)院以來,已引入包括首個藥品“抗D免疫球蛋白注射液”和首個醫(yī)療器械“磁力可控延長鈦棒”等共13藥3械,已有360余人次患者享受政策福利。
而根據(jù)《工作方案》所提出的總體目標,到2022年,基本建立粵港澳大灣區(qū)內(nèi)地醫(yī)療機構(gòu)使用港澳上市藥品醫(yī)療器械的體制機制;到2035年,建立完善的粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管協(xié)調(diào)機制,為港澳和大灣區(qū)內(nèi)地居民提供便利的藥品醫(yī)療器械產(chǎn)品及服務。
香港大學深圳醫(yī)院院長盧寵茂此前在接受《醫(yī)藥經(jīng)濟報》獨家專訪時表示,醫(yī)療同質(zhì)化、一體化其實是大灣區(qū)非常重要的課題,最終可以運用創(chuàng)新藥械產(chǎn)品,在深圳乃至整個大灣區(qū)使用的數(shù)據(jù),也就是作為真實世界數(shù)據(jù),幫助這些國際創(chuàng)新藥械產(chǎn)品盡快提交給國家藥監(jiān)局進行審批,從而加快整個創(chuàng)新產(chǎn)品在國內(nèi)的可及和使用,這對于提升大灣區(qū)醫(yī)療服務和醫(yī)藥創(chuàng)新水平非常重要。同時,未來對于整個國家的醫(yī)療衛(wèi)生水平也會帶來正面的支持和推動作用。
第二批粵港澳大灣區(qū)內(nèi)地
臨床急需進口港澳藥品醫(yī)療器械目錄
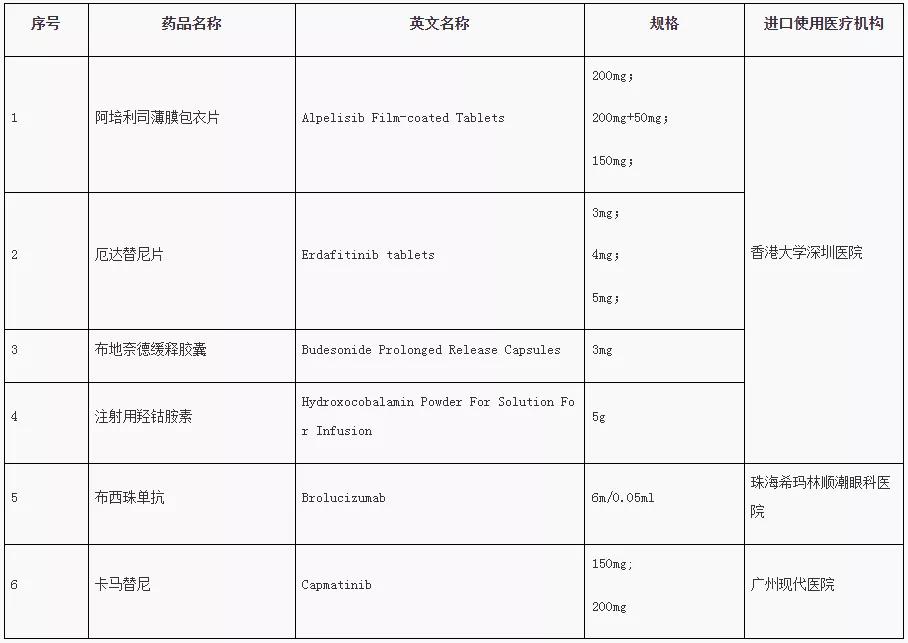
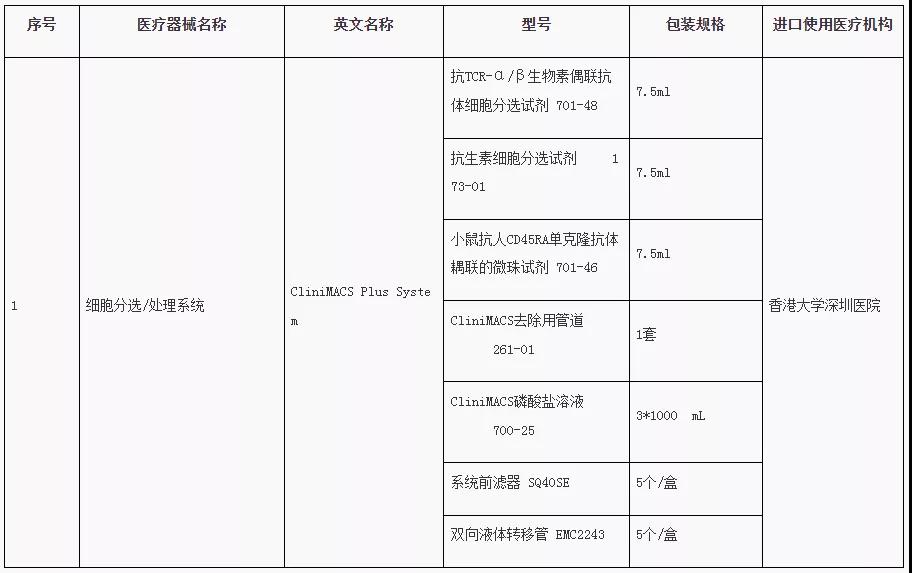
第一批粵港澳大灣區(qū)內(nèi)地
臨床急需進口港澳藥品醫(yī)療器械目錄