1月5日,國家藥監(jiān)局藥審中心網(wǎng)站發(fā)布《基于“三結(jié)合”注冊審評證據(jù)體系下的溝通交流技術(shù)指導(dǎo)原則(征求意見稿)》(以下簡稱“意見稿”),征求意見時限為自發(fā)布之日起1個月。
意見稿針對在中醫(yī)藥理論、人用經(jīng)驗、臨床試驗相結(jié)合的中藥注冊審評證據(jù)體系(以下簡稱“三結(jié)合”審評證據(jù)體系)下研發(fā)的中藥新藥,提出不同注冊分類臨床方面溝通交流的關(guān)鍵節(jié)點、會議資料要求以及關(guān)注點,其中包括人用經(jīng)驗數(shù)據(jù)。
突出人用經(jīng)驗關(guān)鍵地位
2019年10月發(fā)布的《中共中央國務(wù)院關(guān)于促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展的意見》,提出了“三結(jié)合”審評證據(jù)體系的要求?;谥兴幯邪l(fā)規(guī)律,國家藥監(jiān)局發(fā)布的《中藥注冊分類及申報資料要求》對中藥注冊分類進(jìn)行調(diào)整,重點優(yōu)化了體現(xiàn)中藥特點的中藥復(fù)方制劑的注冊申報路徑,豐富了古代經(jīng)典名方中藥復(fù)方制劑范圍。同時,根據(jù)品種是否按照“三結(jié)合”審評證據(jù)體系進(jìn)行研發(fā),制定了不同的技術(shù)要求。
隨著“三結(jié)合”審評證據(jù)體系的相關(guān)指導(dǎo)原則、技術(shù)要求正在通過審評實踐不斷豐富完善。意見稿分別明確了1.1類中藥復(fù)方制劑、3.1類按古代經(jīng)典名方目錄管理的中藥復(fù)方制劑以及3.2類其他來源于古代經(jīng)典名方的中藥復(fù)方制劑等的溝通交流關(guān)注點,且根據(jù)古代經(jīng)典名方中藥復(fù)方制劑由專家審評的規(guī)定,基于專家審評對申報資料完整性的需要,提出了溝通交流階段會議資料方面的要求。
其中,對于1.1類中藥復(fù)方制劑,溝通交流關(guān)注點集中于中醫(yī)藥理論、人用經(jīng)驗與臨床試驗。意見稿指出,在1.1類中藥研發(fā)各關(guān)鍵階段,申請人應(yīng)基于所研發(fā)品種的中醫(yī)藥治療優(yōu)勢和特點,緊扣臨床定位,持續(xù)動態(tài)評估已有研究資料對擬定功能主治、有效性和安全性的支持情況,能夠回答哪些藥物上市必須回答的臨床問題,對注冊申請事項的支持程度,并根據(jù)品種特點合理規(guī)劃研發(fā)路徑。
值得關(guān)注的是,意見稿突出了人用經(jīng)驗在“三結(jié)合”審評證據(jù)體系中的關(guān)鍵地位,將有關(guān)人用經(jīng)驗的溝通交流,總結(jié)為人用經(jīng)驗研究方案的溝通、人用經(jīng)驗數(shù)據(jù)的溝通,并分別提出會議資料要求和關(guān)注點。同時,鼓勵在早期研發(fā)階段,有預(yù)先設(shè)計地開展獲取人用經(jīng)驗的臨床研究。
一直以來,中藥人用經(jīng)驗的主要來源是古籍醫(yī)案、醫(yī)療機(jī)構(gòu)制劑及名老中醫(yī)等專家經(jīng)驗方。隨著中藥創(chuàng)新監(jiān)管政策實踐落地,業(yè)內(nèi)專家普遍認(rèn)為,“人用經(jīng)驗”不直接等同于“人用數(shù)據(jù)”,更不是簡單的堆砌病案資料,而是需要通過嚴(yán)謹(jǐn)?shù)恼撟C總結(jié)為“人用證據(jù)”。因此獲取人用經(jīng)驗的過程是逐步探索明確中藥復(fù)方制劑有效性、安全性特點以及臨床價值的過程,其研究可以貫穿藥物研發(fā)的始終。
政策紅利疊加
近年來,國家發(fā)布了系列政策文件指導(dǎo)中醫(yī)藥工作,明確將中藥新藥創(chuàng)制作為中醫(yī)藥發(fā)展的重點任務(wù)之一,建立中醫(yī)藥理論、人用經(jīng)驗、臨床試驗相結(jié)合的中藥特色審評證據(jù)體系,為中藥新藥研發(fā)帶來了新的歷史發(fā)展機(jī)遇。
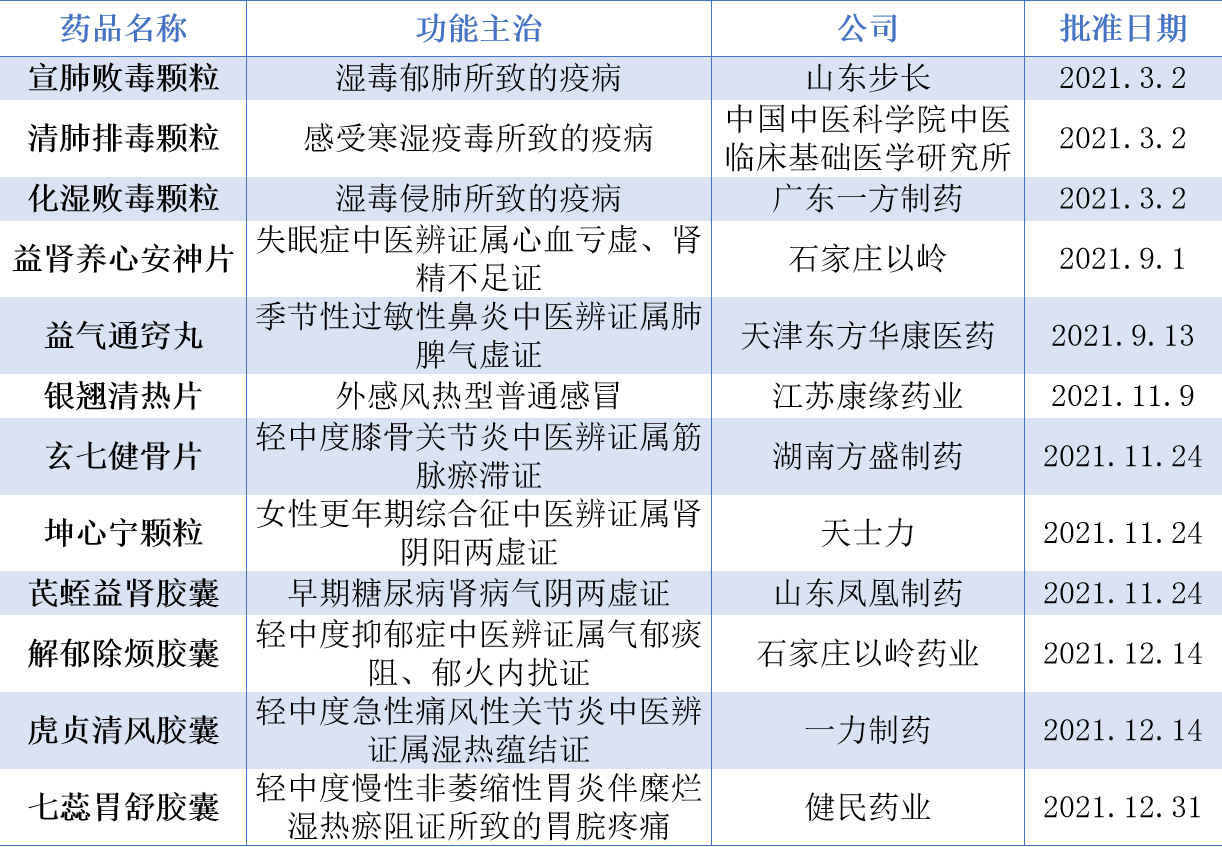
2021年共有12款中藥新藥獲NMPA批準(zhǔn),成為近5年來獲批中藥新藥最多的一年。其中,康緣藥業(yè)的銀翹清熱片是自2020年7月1日新的中藥注冊分類實施以來首個獲批上市的中藥創(chuàng)新藥;天士力的坤心寧顆粒,用于女性更年期綜合征中醫(yī)辨證屬腎陰陽兩虛證的治療;一力制藥的虎貞清風(fēng)膠囊,用于輕中度急性痛風(fēng)性關(guān)節(jié)炎中醫(yī)辨證屬濕熱蘊(yùn)結(jié)證的治療;以嶺藥業(yè)的解郁除煩膠囊,用于輕中度抑郁癥中醫(yī)辨證屬氣郁痰阻、郁火內(nèi)擾證的治療。
值得關(guān)注的是,上述品種均是在中醫(yī)臨床經(jīng)驗方基礎(chǔ)上研制的中藥創(chuàng)新藥,通過開展隨機(jī)、雙盲、安慰劑平行對照、多中心臨床試驗,多中心臨床研究取得的現(xiàn)代循證證據(jù),獲得了藥品監(jiān)管部門的高度認(rèn)可。
2021年NMPA批準(zhǔn)的中藥新藥
堅持以臨床價值為導(dǎo)向,構(gòu)建中醫(yī)藥理論、人用經(jīng)驗和臨床試驗“三結(jié)合”的中藥審評證據(jù)體系,推動建立與中藥臨床定位相適應(yīng)、體現(xiàn)其作用特點和優(yōu)勢的療效評價標(biāo)準(zhǔn)正在成為新時期中醫(yī)藥邁向高質(zhì)量發(fā)展的重要創(chuàng)新路徑。
此外,2021年國家藥監(jiān)局還緊急批準(zhǔn)了在新冠疫情中立下“戰(zhàn)功”的“三藥三方”中的“三方”——清肺排毒顆粒、化濕敗毒顆粒、宣肺敗毒顆粒上市,“三方”均按3.1類注冊上市。由此可見,中藥特色審評審批制度改革已初顯成效,中藥創(chuàng)新藥迎來了新的發(fā)展機(jī)遇。
近年來,國家發(fā)布了系列政策文件指導(dǎo)中醫(yī)藥工作,將中醫(yī)藥納入國家級發(fā)展規(guī)劃,為中醫(yī)藥市場打下堅實基礎(chǔ)。相關(guān)政策不斷推動中西醫(yī)協(xié)調(diào)發(fā)展,為中醫(yī)藥行業(yè)營造了更優(yōu)異的成長環(huán)境。
2021年2月9日,國務(wù)院辦公廳印發(fā)《關(guān)于加快中醫(yī)藥特色發(fā)展的若干政策措施》,要求進(jìn)一步落實《中共中央國務(wù)院關(guān)于促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展的意見》和全國中醫(yī)藥大會部署,遵循中醫(yī)藥發(fā)展規(guī)律,認(rèn)真總結(jié)中醫(yī)藥防治新冠肺炎經(jīng)驗做法,破解存在的問題,更好發(fā)揮中醫(yī)藥特色和比較優(yōu)勢,推動中醫(yī)藥和西醫(yī)藥相互補(bǔ)充、協(xié)調(diào)發(fā)展。
2021年6月30日,《關(guān)于進(jìn)一步加強(qiáng)綜合醫(yī)院中醫(yī)藥工作推動中西醫(yī)協(xié)同發(fā)展的意見》發(fā)布。進(jìn)一步完善中西醫(yī)協(xié)同相關(guān)制度,加強(qiáng)綜合醫(yī)院中醫(yī)臨床科室設(shè)置和中藥房設(shè)置,創(chuàng)新中西醫(yī)協(xié)作醫(yī)療模式等指導(dǎo)意見。
2021年10月11日,廣東省醫(yī)保局印發(fā)《廣東省醫(yī)療保障局關(guān)于開展醫(yī)保支付改革促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展的指導(dǎo)意見》,提出推進(jìn)中醫(yī)藥服務(wù)醫(yī)保支付改革的多種措施,旨在深化醫(yī)保支付制度改革,促進(jìn)中醫(yī)藥高質(zhì)量發(fā)展,滿足人民群眾對中醫(yī)藥服務(wù)需求。
2021年12月30日,國家醫(yī)保局、國家中醫(yī)藥管理局聯(lián)合下發(fā)《關(guān)于醫(yī)保支持中醫(yī)藥傳承創(chuàng)新發(fā)展的指導(dǎo)意見》明確指出,一般中醫(yī)醫(yī)療服務(wù)項目可繼續(xù)按項目付費,中醫(yī)醫(yī)療機(jī)構(gòu)可暫不實行DRG付費,對已經(jīng)實行DRG和按病種分值付費的地區(qū),適當(dāng)提高中醫(yī)醫(yī)療機(jī)構(gòu)、中醫(yī)病種的系數(shù)和分值。
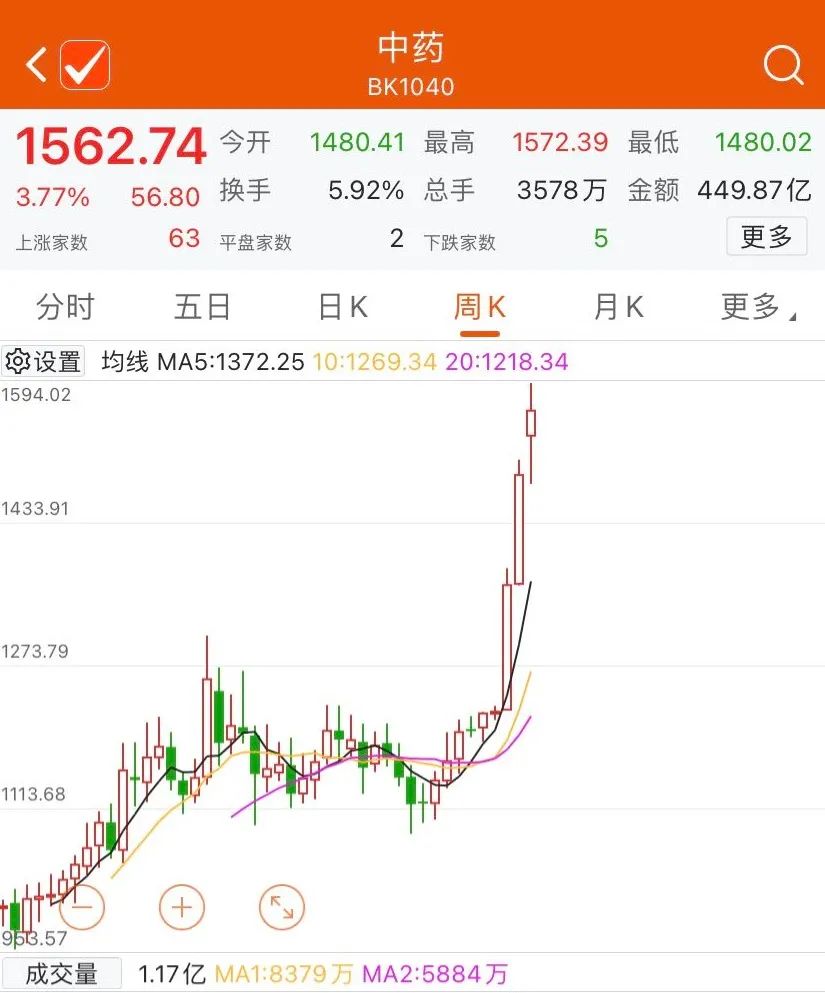
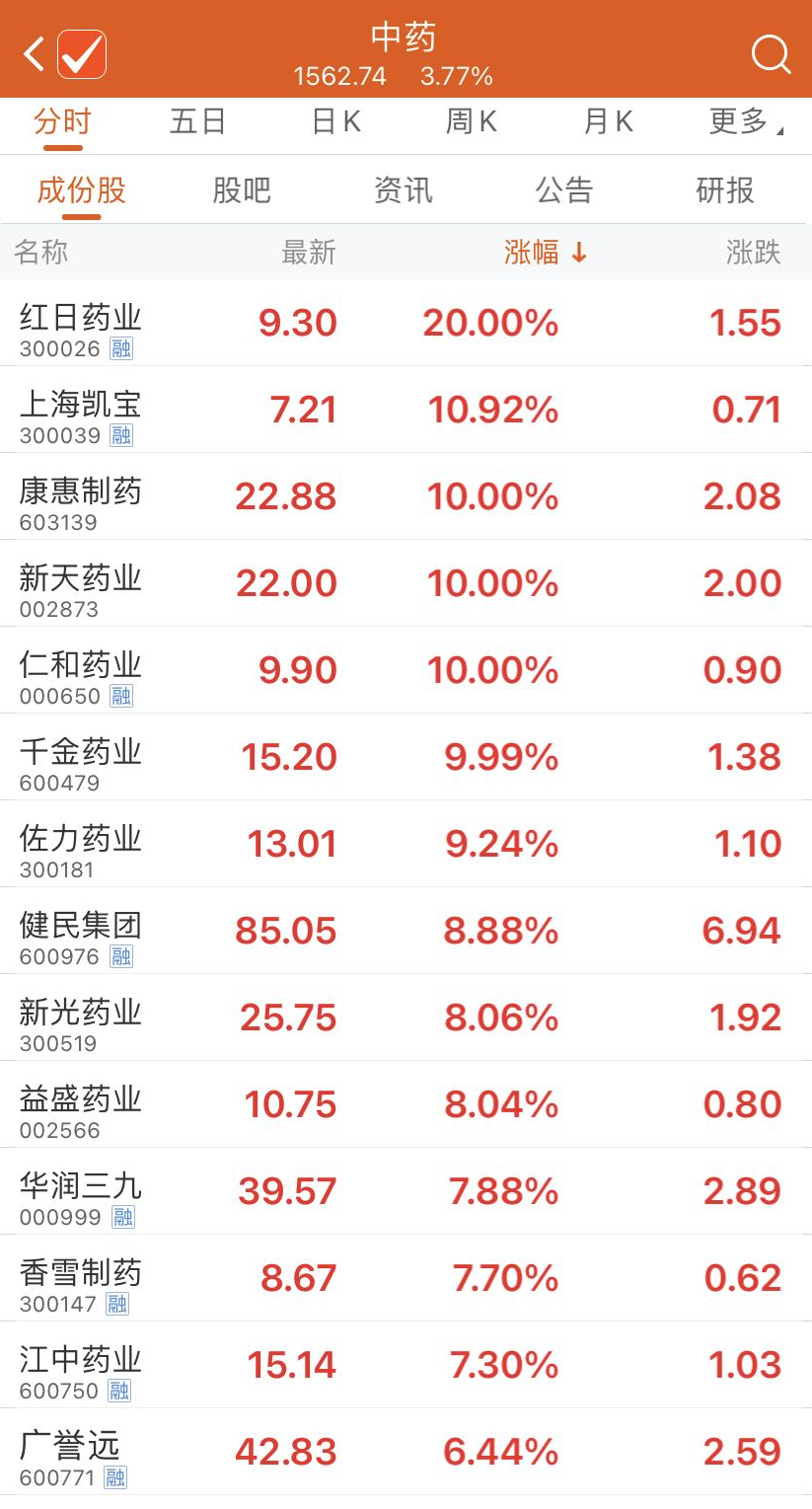
中藥板塊應(yīng)聲上漲
受多個利好政策的影響,中醫(yī)藥板塊商業(yè)價值愈發(fā)受到資本市場的認(rèn)可。1月6日中藥板塊再度大漲3.77%,上海凱寶漲10.92%,佐力藥業(yè)、健明集團(tuán)、新光藥業(yè)等漲幅超前,紅日藥業(yè)、康惠制藥、心田藥業(yè)、仁和藥業(yè)、千金藥業(yè)等漲停。值得注意的是,紅日藥業(yè)2021年12月21日至今累計漲幅已達(dá)110.41%。
中醫(yī)藥領(lǐng)域邁向發(fā)展新階段所釋放出的產(chǎn)業(yè)和資本紅利,集中反映出行業(yè)對于高質(zhì)量創(chuàng)新的旺盛需求。本次征求意見稿的發(fā)布,必將推動企業(yè)申請人和監(jiān)管部門的溝通互動,加速藥品轉(zhuǎn)化上市,進(jìn)一步提高中藥的創(chuàng)新能力。









