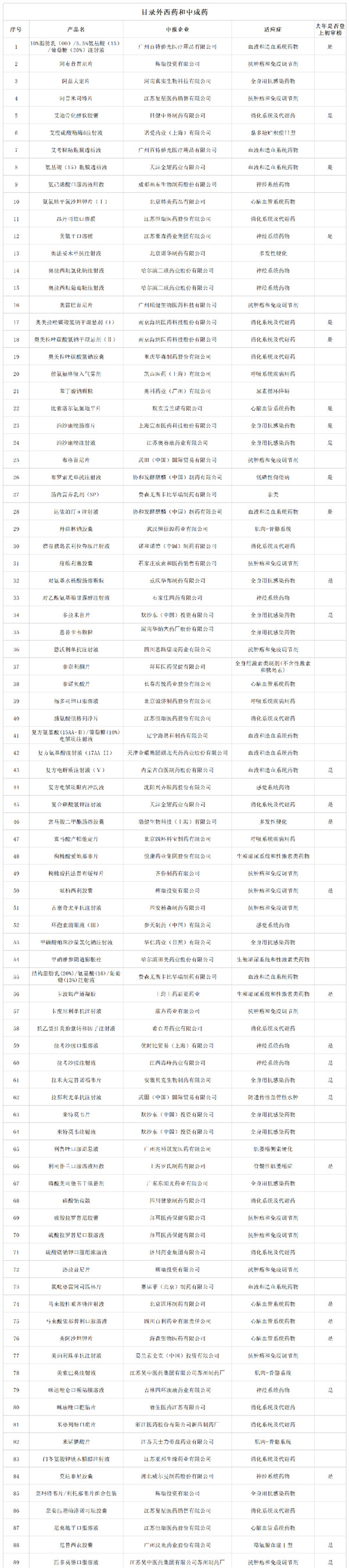
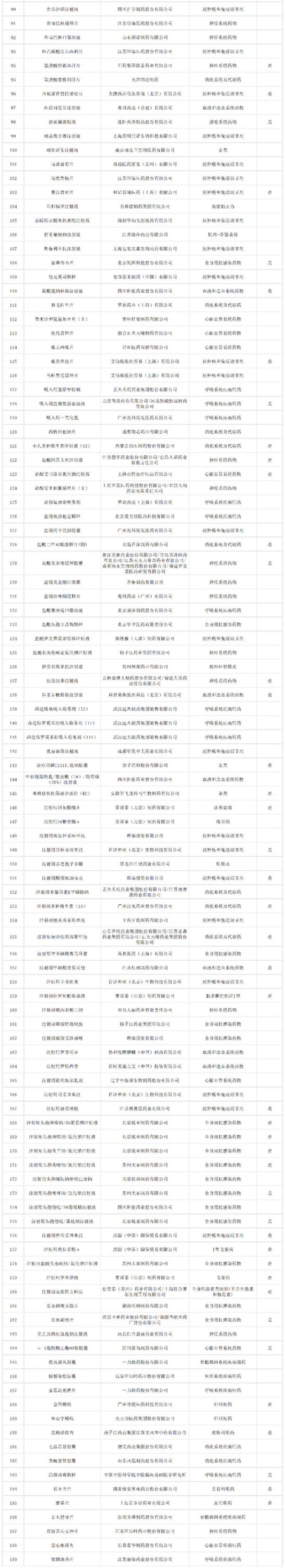
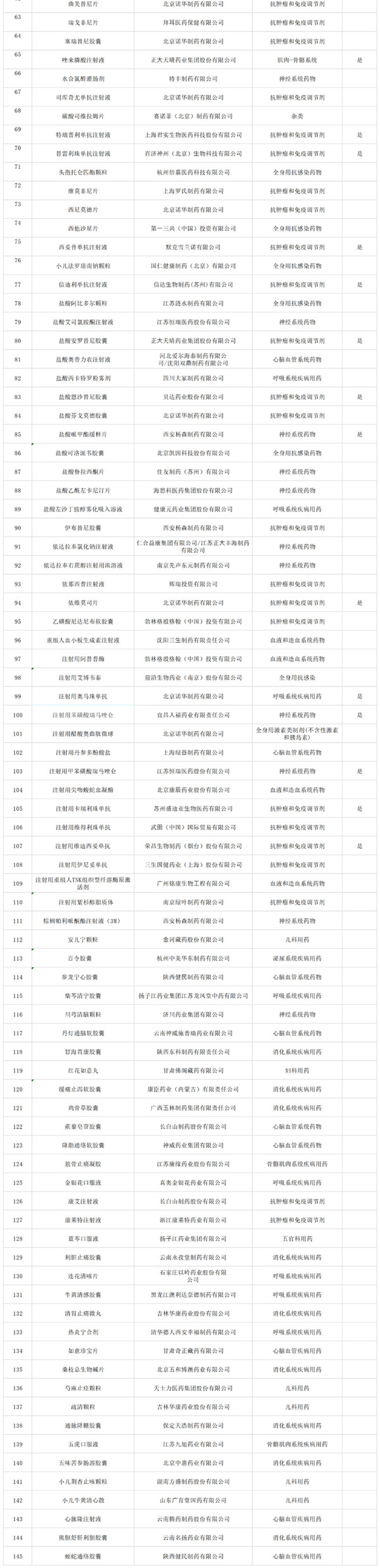
9月6日晚,國家醫(yī)保局發(fā)布《關(guān)于公示2022年國家基本醫(yī)療保險、工傷保險和生育保險藥品目錄調(diào)整通過初步形式審查的藥品及相關(guān)信息的公告》(以下簡稱“《公告》”),共有344 個品種通過初審,包括目錄外西藥和中成藥 199 個,以及目錄內(nèi)西藥和中成藥 145 個,公示時間為一周(截止至 12 日)。
根據(jù)《2022年國家基本醫(yī)療保險、工傷保險和生育保險藥品目錄調(diào)整通過初步形式審查的藥品名單公示情況解讀》,2022年7月1日9時至2022年7月14日17時,國家醫(yī)保信息平臺共收到企業(yè)申報信息537條,涉及藥品(通用名,下同)490個。
經(jīng)審核,344個藥品通過初步形式審查,通過比例為70%。與2021年(474個藥品271個通過)相比,申報和通過初步形式審查的藥品數(shù)量都有一定增加。通過率方面,目錄外藥品比例為60%,目錄內(nèi)藥品比例為91%。(具體名單見文末)
醫(yī)保藥品目錄調(diào)整分為企業(yè)申報、形式審查、專家評審、談判競價等環(huán)節(jié),形式審查只是其中之一。通過形式審查,表明該藥品有資格進入下一步的專家評審環(huán)節(jié),只有順利通過目錄調(diào)整的所有環(huán)節(jié),才能最終被納入國家醫(yī)保藥品目錄。
近90款腫瘤藥“霸榜”
進口PD-(L)1集體“失聲”?
從適應癥來看,抗腫瘤和免疫調(diào)節(jié)劑入選初審目錄數(shù)量最多,共89個,位居其后的依次是神經(jīng)系統(tǒng)藥物40個,全身用抗感染藥物36個,呼吸系統(tǒng)基本用藥27個。群雄逐鹿醫(yī)保之戰(zhàn)打響,腫瘤免疫治療藥物PD-(L)1單抗當仁不讓再成為最受關(guān)注的“選手”。
根據(jù)醫(yī)保目錄調(diào)整方案,在2022年6月30日前獲批的創(chuàng)新藥或適應癥,有望參與2022年國家醫(yī)保談判納入新版國家醫(yī)保目錄。就PD-(L)1單抗來說,共12項適應癥待醫(yī)保談判。
截至目前,國內(nèi)已獲批上市14款PD-1/L1單抗、1款PD-1+CTLA-4雙抗,其中PD-1單抗10款(8款國產(chǎn)、2款進口)、PD-L1單抗4款(2款國產(chǎn)、2款進口)、PD-1+CTLA-4雙抗1款(國產(chǎn))。國內(nèi)藥企包括信達生物、恒瑞醫(yī)藥、百濟神州、君實生物、康方生物、譽衡生物、復宏漢霖、基石藥業(yè)、康寧杰瑞/思路迪/先聲藥業(yè)均有PD-(L)1產(chǎn)品參與角逐。
從初審名單中來看,有復宏漢霖的斯魯利單抗注射液、康寧杰瑞的恩沃利單抗注射液、康方生物的卡度尼利單抗注射液入圍,也意味著譽衡生物、基石藥業(yè)旗下PD-(L)1產(chǎn)品無疑將無緣今年醫(yī)保目錄。
令人驚訝的是,常年陪跑的進口PD-(L)1產(chǎn)品,本次醫(yī)保談判直接集體“失聲”,無論是默沙東的帕博利珠單抗、BMS的納武利尤單抗,還是羅氏的阿替利珠單抗、阿斯利康的度伐利尤單抗,全部沒有出現(xiàn)在初審名單之中。
事實上,默沙東的帕博利珠單抗、BMS的納武利尤單抗和阿斯利康的度伐利尤單抗通過了2021年醫(yī)保談判初審名單,但從結(jié)果來看,3家進口PD-(L)1再次缺席國家醫(yī)保。在業(yè)內(nèi)看來,進口企業(yè)放棄醫(yī)保主要是由于國內(nèi)PD-(L)1 市場競爭日趨激烈,價格持續(xù)下探。
初代國產(chǎn)PD-1“F4”,君實生物的特瑞普利單抗、信達生物的信迪利單抗、恒瑞醫(yī)藥的卡瑞利珠單抗、百濟神州的替雷利珠單抗預計此次將攜新適應癥參與談判,今年這4款PD-1分別新增2、2、4、4項新適應癥,新適應癥也讓PD-1/L1市場將面臨更加復雜的競爭格局。
有分析指出,因新增適應癥帶來更多的醫(yī)保基金增量必然面臨價格的進一步下調(diào),今年新適應癥的談判依然十分激烈。
外企熱情高漲
諾華產(chǎn)品數(shù)量最多
今年有9家企業(yè)申報藥品數(shù)超過5個,其中,諾華制藥攜14款藥品參加今年的醫(yī)保談判,成為本屆醫(yī)保談判申報藥品最多的企業(yè)。
在諾華的14款藥品中,除奧法妥木單抗注射液外,其余藥品此前均已通過醫(yī)保談判納入醫(yī)保目錄,本次初審名單中的艾曲泊帕乙醇胺片、依維莫司片和注射用奧馬珠單抗等備受關(guān)注的產(chǎn)品,已經(jīng)在往年的醫(yī)保談判中吸引了眾多目光。
以艾曲泊帕乙醇胺片為例,2017 年 12 月該產(chǎn)品獲批進入中國,商品名為瑞弗蘭,2020 年其全球銷售額達到 17.38 億美元,同比增長 23.0%,在諾華產(chǎn)品銷售榜單中排第六。公開數(shù)據(jù)顯示,2019 年艾曲泊帕在國內(nèi)銷售額 6900 多萬元。2019 年,艾曲泊帕乙醇胺成功進入國家醫(yī)保乙類范圍,且在 2020 年成功續(xù)約。
此外,2020年通過優(yōu)先審評審批程序獲批上市,并在當年的醫(yī)保談判中成功進入醫(yī)保目錄的的1類創(chuàng)新藥西尼莫德片,也登上今年的醫(yī)保談判初審榜。西尼莫德用于治療成人復發(fā)型多發(fā)性硬化,多發(fā)性硬化是一種需要長期用藥的慢性病,患者對口服藥物需求強烈。諾華曾在2010年9月推出全球首個治療MS的S1PR調(diào)節(jié)劑Gilenya(芬戈莫德),這也是首個可以降低MS患者復發(fā)頻率的口服療法。
排名第二的是輝瑞,今年醫(yī)保談判藥品數(shù)量為11個,其中,哌柏西利膠囊、注射用醋酸地加瑞克去年也登上初審榜。
排名第三的是江蘇恒瑞,作為從仿制藥向創(chuàng)新藥轉(zhuǎn)型的傳統(tǒng)藥企,恒瑞攜10款產(chǎn)品參與本次醫(yī)保談判,誠意滿滿,其中包括脯氨酸恒格列凈片、羥乙磺酸達爾西利片、瑞維魯胺片、馬來酸吡咯替尼片和注射用甲苯磺酸瑞馬唑侖5款國產(chǎn)原研藥。其中,脯氨酸恒格列凈片是2021年底獲批上市的1類新藥,也是首個國產(chǎn)創(chuàng)新SGLT-2抑制劑。
賽諾菲(北京)、阿斯利康(無錫)和正大天晴申報藥品數(shù)為7個;拜耳申報藥品數(shù)為6個;江蘇豪森和百濟神州(北京)申報藥品數(shù)為5個。
“天價”CAR-T產(chǎn)品再引關(guān)注
中藥企業(yè)積極踴躍成“大年”
一些特殊用藥領(lǐng)域,也值得市場關(guān)注。
藥明巨諾帶來了國產(chǎn)第二款CAR-T產(chǎn)品瑞基奧侖賽注射液(信諾達),該藥在2021年9月獲批上市,并于今年首次進入醫(yī)保談判目錄。
事實上,這次是CAR-T領(lǐng)域產(chǎn)品第二次向醫(yī)保目錄發(fā)起沖擊。在去年復星凱特帶著全國首款國內(nèi)獲批的CAR-T產(chǎn)品阿基侖賽注射液申請醫(yī)保談判也是引起了廣泛的關(guān)注,120萬/支的價格更是吸引了市場目光,不過,該產(chǎn)品的談判最后還是以失敗告終;而在今年的初審名單中,阿基侖賽注射液已經(jīng)難覓蹤影。
瑞基奧侖賽注射液129萬/針的采購掛網(wǎng)價,比復星凱特的120萬/針的阿基侖賽注射液還要貴9萬元,有了去年復星凱特的前車之鑒,藥明巨諾產(chǎn)品定價此次依然主動申報醫(yī)保談判,究竟是為了吸引流量,還是真有信心將產(chǎn)品價格壓下來而去直面醫(yī)保談判“靈魂砍價”?“降幅多少”也成為了大眾關(guān)注的焦點。
在中成藥領(lǐng)域,回溯2021年12月,國家醫(yī)療保障局辦公室、國家中醫(yī)藥管理局辦公室聯(lián)合發(fā)布《國家醫(yī)療保障局 國家中醫(yī)藥管理局關(guān)于醫(yī)保支持中醫(yī)藥傳承創(chuàng)新發(fā)展的指導意見》提出支持中醫(yī)藥傳承創(chuàng)新發(fā)展建議。意見提出要將適宜的中藥和中醫(yī)醫(yī)療服務項目納入醫(yī)保支付范圍。
本次初審目錄中,?力制藥的金蓮花泡騰片等呼吸系統(tǒng)疾病藥,陜西健民的七蕊胃舒膠囊等消化系統(tǒng)疾病用藥,奇正藏藥的如意珍寶片、神威藥業(yè)的降脂通絡軟膠囊等心腦血管藥,依舊是中成藥領(lǐng)域在醫(yī)保目錄里的主流藥物。
值得關(guān)注的是像天津天士力、吉林華康等一眾企業(yè)帶來了如芍麻止痙顆粒、疏清顆粒等兒科用藥。在推動中藥產(chǎn)品發(fā)展的同時,也豐富了兒科用藥選擇。打破了此前醫(yī)保目錄中兒科用藥只有西藥的局限。
除此之外,國家醫(yī)保局表示,在疫情防控常態(tài)化背景下,國家醫(yī)保局對新冠肺炎治療藥品給予了高度重視,并將納入《新型冠狀病毒肺炎診療方案》的藥品”作為申報條件之一。在新版的新冠診療方案中,就包含了多款在中國新上市的新冠治療藥品,其中我國首款新冠口服藥阿茲夫定片也通過了初審名單。
罕見病再引關(guān)注
賽諾菲全面加速
2021年末國家醫(yī)保談判中的一句“每一個小群體都不應該被放棄”引爆輿論后,罕見病、少見病治療藥物的用藥需求被大眾所知悉。
今年的初審目錄中,在繼續(xù)支持創(chuàng)新藥的基礎上,還著重體現(xiàn)了對罕見病治療藥物的關(guān)注。據(jù)統(tǒng)計,本次初審目錄共近20個罕見病、少見病領(lǐng)域藥物。
去年,曾經(jīng)高達70萬/針的諾西那生鈉注射液降到“平民價”,引發(fā)了醫(yī)藥市場廣泛關(guān)注。今年,同樣作為脊髓性肌萎縮癥(SMA)治療藥物的利司撲蘭口服溶液用散,也被列入初審目錄。
值得注意的是,賽諾菲、武田等跨國藥企均有不止一款藥物入圍該領(lǐng)域名單。武?研發(fā)的兩款藥物分別為防遺傳性?管性水腫的拉那利尤單抗注射液,1型戈謝病治療藥物注射用維拉苷酶α。
賽諾菲產(chǎn)品數(shù)量最多,有4款產(chǎn)品入圍初審目錄,包括治療龐貝病的注射用阿糖苷酶α、法布雷病的注射用阿加糖酶β、黏多糖貯積癥的注射用拉羅尼酶濃溶液、戈謝病的注射用伊米苷酶等。
此外,協(xié)和發(fā)酵麒麟(中國)制藥有限公司治療低磷性佝僂病的布羅索尤單抗注射液,諾華治療多發(fā)性硬化的奧法妥木單抗注射液,渤健治療多發(fā)性硬化癥的富馬酸二甲酯腸溶膠囊也在初審名單之上。
本土企業(yè)在罕見病領(lǐng)域也開始“高歌猛進”!諾愛藥業(yè)治療黏多糖貯積癥II型的艾度硫酸酯酶ß注射液,廣州兆科聯(lián)發(fā)醫(yī)藥研發(fā)治療肌萎縮側(cè)索硬化的利魯唑口服混懸液,漢光藥業(yè)治療酪氨酸血癥Ⅰ型的尼替西農(nóng)膠囊,兆科藥業(yè)治療尿素循環(huán)障礙的苯丁酸鈉顆粒,萬邦德制藥治療重癥肌無力的石杉堿甲注射液,恒邦藥業(yè)治療視神經(jīng)脊髓炎的伊奈利珠單抗注射液等。
名單如下: