3月11日訊 3月8日,國家藥品監(jiān)督管理局政務服務門戶更新《不予注冊批件發(fā)布通知》,杭州安旭生物科技股份有限公司(簡稱“安旭生物”)關鍵產(chǎn)品——人類免疫缺陷病毒抗體/丙型肝炎病毒抗體/乙型肝炎病毒表面抗原/梅毒螺旋體抗體聯(lián)合檢測試劑盒(免疫層析法),正式給予不予注冊批件。

事實上,今年1月,國家藥品監(jiān)督管理局發(fā)布《關于2020年醫(yī)療器械臨床試驗監(jiān)督抽查中的真實性問題的公告》,明確認定安旭生物的這一款監(jiān)測試劑盒產(chǎn)品存在多項臨床試驗真實性問題,并根據(jù)《中華人民共和國行政許可法》和《體外診斷試劑注冊管理辦法》給予處罰。
自2015年以來,國家藥品監(jiān)管部門嚴格落實“四個最嚴”精神,頒布多項法規(guī)政策,旨在強化藥械臨床試驗管理,重拳監(jiān)管臨床試驗數(shù)據(jù)真實性、準確性、完整性問題,確保研究過程可追溯性。業(yè)內分析指出,如今的臨床試驗不應當抱有僥幸心理,真實、合規(guī)地開展臨床試驗是產(chǎn)品順利獲得監(jiān)管認可的政策“紅線”。
IPO前產(chǎn)品“爆雷”
臨床數(shù)據(jù)無法溯源
為加強對醫(yī)療器械臨床試驗監(jiān)督管理,國家藥品監(jiān)督管理局于2020年11月對在審的10個醫(yī)療器械注冊申請項目開展了臨床試驗監(jiān)督抽查,涉及27家臨床試驗機構。
國家藥監(jiān)局檢查發(fā)現(xiàn),杭州安旭生物科技股份有限公司生產(chǎn)的人類免疫缺陷病毒抗體/丙型肝炎病毒抗體/乙型肝炎病毒表面抗原/梅毒螺旋體抗體聯(lián)合檢測試劑盒(免疫層析法)(受理號:CSZ2000162)在浙江大學醫(yī)學院附屬第一醫(yī)院開展的臨床試驗中,醫(yī)療機構留檔的電子照片拍攝時間、地點與臨床試驗實際時間、地點不一致,臨床試驗數(shù)據(jù)無法溯源。
臨床數(shù)據(jù)造假事件發(fā)生后,國家藥監(jiān)局根據(jù)《中華人民共和國行政許可法》和《體外診斷試劑注冊管理辦法》規(guī)定,對該注冊申請項目做出不予注冊決定,并自不予注冊之日起一年內不予再次受理該項目的注冊申請;同時,責成浙江省藥品監(jiān)督管理局切實履行對杭州安旭生物科技股份有限公司和相關臨床試驗機構的屬地監(jiān)管責任,依法依規(guī)調查處理。
值得注意的是,安旭生物是一家擬科創(chuàng)板上市公司。據(jù)悉,2020年6月2日,安旭生物科創(chuàng)板上市申請獲受理,擬募資4.59億元;2020年11月3日,安旭生物通過上市委會議;2020年12月30日,提交科創(chuàng)板注冊。
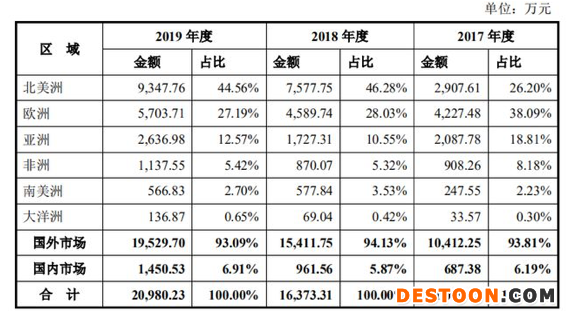
安旭生物招股書顯示,其主營POCT試劑及儀器,涵蓋毒品檢測系列、傳染病檢測系列等8大類,產(chǎn)品銷售以外銷為主,2017-2019年,安旭生物的境外收入分別為1.04億元、1.54億元、1.95億元。
安旭生物招股書
事實上,安旭生物所處的細分市場競爭頗為激烈,境內主要對手包括東方生物、萬孚生物、基蛋生物以及明德生物等。相比較而言,由于安旭生物在產(chǎn)品品種數(shù)量、生產(chǎn)規(guī)模及技術開發(fā)方面和頭部企業(yè)仍存在較大差距,迫切需要通過資本市場助力企業(yè)發(fā)展。然而,就在企業(yè)上市關鍵時刻,重要在研產(chǎn)品爆雷,讓行業(yè)對公司IPO未來前景不無擔憂。
安旭生物此前公開表示,這次造假事件主要源自醫(yī)療機構出現(xiàn)問題,公司委托浙江大學醫(yī)學院附屬第一醫(yī)院進行臨床試驗,抽查發(fā)現(xiàn)的問題主要責任對象是醫(yī)療機構,公司也是事件的受害者。
然而,這一說法顯然無法平復質疑。市場分析認為,按照新版《藥物臨床試驗質量管理規(guī)范》(GCP)要求,明確申辦者作為臨床試驗質量和可靠性的最終責任主體,需要建立質量管理體系,基于風險進行質量管理,加強質量保證和質量控制,建立獨立數(shù)據(jù)監(jiān)查委員會,開展基于風險評估的監(jiān)查和稽查等,企業(yè)責任在臨床試驗全周期質量管理中都是核心主體。
堅決貫徹“四個最嚴”
臨床試驗質量重拳監(jiān)管
臨床試驗各主體建立完善的質量保證體系是確保項目高質量完成的基石。堅決貫徹“四個最嚴”精神,切實提高藥械臨床試驗質量,促進臨床試驗水平的提升,強化臨床試驗研究者的責任意識,保證臨床試驗數(shù)據(jù)的真實性、準確性、完整性,確保研究過程可追溯性,正是藥品監(jiān)管部門多年來的工作重點。
3月10日,山西省藥監(jiān)局發(fā)布《關于開展對藥物臨床試驗機構監(jiān)督檢查的通知》,決定對省內藥物臨床試驗機構開展監(jiān)督檢查,旨在加強全省藥物臨床試驗的監(jiān)督管理,掌握藥物臨床試驗機構開展藥物臨床試驗的情況。
在此之前,黑龍江、山東、四川等省份陸續(xù)發(fā)布通知,加強藥物臨床試驗機構備案管理工作,大幅提升臨床試驗監(jiān)管水平;北京、天津、河北三地藥品監(jiān)督管理局共同制定的《京津冀藥物臨床試驗機構備案后首次監(jiān)督檢查標準(征求意見稿)》,要求臨床試驗機構有不符合要求的“缺陷項目”立即整改。
臨床專家指出,在真實性問題方面,參與臨床試驗的各方都應當敬畏生命、敬畏職責和規(guī)章,堅決不編造臨床試驗數(shù)據(jù);確保臨床試驗數(shù)據(jù)可溯源;保證正確使用試驗產(chǎn)品;不瞞報與試驗產(chǎn)品相關的嚴重不良事件、產(chǎn)品缺陷、違禁治療;確保注冊申報資料中數(shù)據(jù)質量等。
在合規(guī)性問題方面,臨床試驗項目組成員應經(jīng)過嚴格培訓和授權,并熟練掌握相關法律法規(guī)和方案的具體要求,整個項目執(zhí)行過程應有成熟的標準操作規(guī)程(SOP)作為指引。
為依法懲治藥械注冊申請材料造假的犯罪行為,頂層政策不斷升級。最高人民法院、最高人民檢察院于2017年發(fā)布《關于辦理藥品、醫(yī)療器械注冊申請材料造假刑事案件適用法律若干問題的解釋》明確:編造受試動物信息、受試者信息等藥物非臨床研究數(shù)據(jù)或者藥物臨床試驗數(shù)據(jù),影響藥品安全性、有效性評價結果的,以“故意提供虛假證明文件”論處,最高可判五年。
前不久,中國裁判文書網(wǎng)公開了上海市普陀區(qū)人民法院的一則刑事判決書,愛恩康臨床醫(yī)學研究(北京)有限公司的一名員工,為加速推進百時美施貴寶(中國)投資有限公司委托其管理的項目,偽造了倫理審查機構的公章,違法用于向中國人類遺傳資源管理辦公室獲取行政許可,最終因犯偽造事業(yè)單位印章罪獲刑。
經(jīng)過數(shù)年臨床試驗重拳監(jiān)管,數(shù)據(jù)質量已經(jīng)得到全產(chǎn)業(yè)鏈高度重視,監(jiān)管部門對數(shù)據(jù)質量問題“零容忍”也得到了廣泛贊譽。行業(yè)普遍認為,唯有真正夯實臨床數(shù)據(jù)真實性、完整性、規(guī)范性,才可能鑄就真正意義的藥械科學研究和技術創(chuàng)新,切實保障上市藥品的安全、有效和質量可控,從根本上提高中國制藥工業(yè)的國際競爭力。



